

合作交流
2018必须关注的31个单抗药物
来源:药事纵横
|
作者:派金生物
|
发布时间: 2018-01-14
|
28946 次浏览
|
分享到:
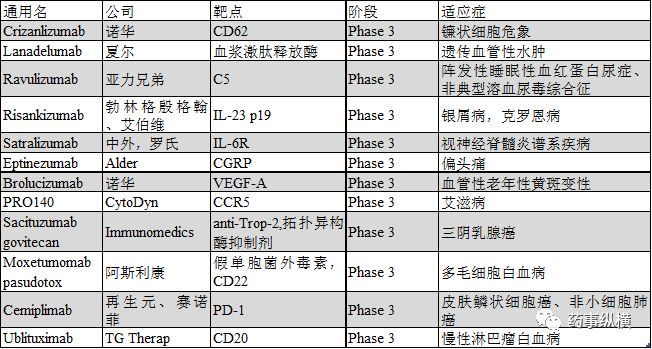
已经获得或近期即将获得关键性临床终点数据,在2018年有望提交BLA的单抗药物有12个,分别为lanadelumab, crizanlizumab, ravulizumab, eptinezumab, risankizumab, satralizumab, brolucizumab, PRO140, sacituzumab govitecan, moxetumomab pasudotox, cemiplimab和ublituximab。根据FDA的审评周期,这12个药物也有望在2018年底或2019年上市,其中前8个为一般药物,后4个是抗癌药。
2018年有望提交上市申请的单抗

Lanadelumab
Lanadelumab (SHP643,DX-2930)是一种人IgG1单抗,可通过抑制血浆激肽释放酶而阻止缓激肽的生产。Lanadelumab在三期临床开展的适应症为遗传性血管性水肿(HAE),遗传血管性水肿是一种以身体受到外界侵害后引发组织水肿为特征的罕见病。Lanadelumab已经获得美国和欧洲授予的HAE孤儿药资格和FDA HAE突破性疗法认定。2017年5月,夏尔报告了一项为期26周的三期临床HELP试验(NCT02586805)数据,该试验就lanadelumab的安全性和阻止 I 型和II型HAE患者急性血管水肿发生率的疗效进行了评估。试验中,49名患者每二周一次给予lanadelumab 300mg,或每四周一次给予lanadelumab 300mg,或每四周一次给予lanadelumab 150mg或安慰剂。结果显示,每二周一次给予lanadelumab 300mg,每四周一次给予lanadelumab 300mg和每四周一次给予lanadelumab 150mg的患者,血管水肿发生率相比安慰剂分别下降87%,73%和76%,试验达到既定的主要终点和次要终点。另一项开放标签的三期临床长期安全有效性研究 (NCT02741596)用以评估lanadelumab阻止 I 型和II型HAE患者急性血管水肿发生的效率,治疗终点将在2018年2月到达。本品的上市申请将在2018年初提交到FDA和EMA。
Crizanlizumab
Lanadelumab (SHP643,DX-2930)是一种人IgG1单抗,可通过抑制血浆激肽释放酶而阻止缓激肽的生产。Lanadelumab在三期临床开展的适应症为遗传性血管性水肿(HAE),遗传血管性水肿是一种以身体受到外界侵害后引发组织水肿为特征的罕见病。Lanadelumab已经获得美国和欧洲授予的HAE孤儿药资格和FDA HAE突破性疗法认定。2017年5月,夏尔报告了一项为期26周的三期临床HELP试验(NCT02586805)数据,该试验就lanadelumab的安全性和阻止 I 型和II型HAE患者急性血管水肿发生率的疗效进行了评估。试验中,49名患者每二周一次给予lanadelumab 300mg,或每四周一次给予lanadelumab 300mg,或每四周一次给予lanadelumab 150mg或安慰剂。结果显示,每二周一次给予lanadelumab 300mg,每四周一次给予lanadelumab 300mg和每四周一次给予lanadelumab 150mg的患者,血管水肿发生率相比安慰剂分别下降87%,73%和76%,试验达到既定的主要终点和次要终点。另一项开放标签的三期临床长期安全有效性研究 (NCT02741596)用以评估lanadelumab阻止 I 型和II型HAE患者急性血管水肿发生的效率,治疗终点将在2018年2月到达。本品的上市申请将在2018年初提交到FDA和EMA。
Crizanlizumab



